La variaciòn en la energìa interna de un sistema es igual a la energìa transferida a los alrededores o por ellos en forma de calor y de trabajo , por lo que la energìa no se crea ni se destruye , solo se transforma.
Matemàticamente esta se expresa asì:
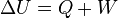
donde:
 es la variación de energía del sistema,
es la variación de energía del sistema, 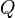 es el calor intercambiado por el sistema a través de unas paredes bien definidas, y
es el calor intercambiado por el sistema a través de unas paredes bien definidas, y  es el trabajo intercambiado por el sistema a sus alrededores.
es el trabajo intercambiado por el sistema a sus alrededores.

SEGUNDA LEY DE LA TERMODINÀMICA.
Esta tiene dos enunciados la del fìsico alemàn Rudolph J.E celcius que dice: el calor no puede por simismo ,sin la intervenciòn de un agente externo ,pasar de un cuerpo frìo a uno caliente.
Y la del fisico inglès William Thomson Kelvin que dice : es imposible construir una maquina termica que transforme todo el trabajo que se le suministra en calor.

TERCERA LEY DE LA TERMODINÀMICA.
Puesto por el fisico y quimico alemàn Walther Nernst que dice: la entropìa de un sòlido cristalino puro y perfecto puede tomarse como cero y a la temperatura del cero absoluto.
Nota: Entropìa es el desgaste del sistema originado por el transcurdo del tiempo y el funcionamiento del sistema. Esto implica anular las diferencias de potencial y su capacidad de trabajo.

PROCESO ISOTERMICO.
Se denomina proceso isotermico o proceso isotermo al cambio de temperatura revercible en un sistema termodinàmico ,siendo dicho cambio constante en todo el sistema.
La compresiòn o expansiòn de un gas ideal en contacto permanente con un termostato este es un ejemplo de proceso isotermico.
Cuando una masa (m) de gas se dilata isotermicamente en contra de una presiòn exterior , la variaciòn de energìa interna es nula , con lo que el calor que se suministra al sistema es igual al trabajo que realiza el gas.
No hay comentarios:
Publicar un comentario