PROCESO ISOCÓRICO
Un proceso isocórico, también llamado proceso isométrico o isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante; ΔV = 0. Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como: ΔW = PΔV, donde P es la presión (el trabajo es positivo, ya que es ejercido por el sistema).

Aplicando la primera ley de la termodinámica, podemos deducir que Q, el cambio de la energía interna del sistema es: Q = ΔU para un proceso isocórico: es decir, todo el calor que transfiramos al sistema quedará a su energía interna, U. Si la cantidad de gas permanece constante, entonces el incremento de energía será proporcional al incremento de temperatura, Q = nCVΔT donde CV es el calor específico molar a volumen constante.

En un diagrama P-V, un proceso isocórico aparece como una línea vertical.
PROCESO ISOBÀRICO
Un proceso isobárico es un proceso termodinámico que ocurre a presión constante. En él, el calor transferido a presión constante está relacionado con el resto de variables mediante:
Donde:
Q = Calor transferido.
u = Energía Interna.
p = Presión.
v = Volumen.
PROCESO ADIABÀTICO.
Durante un proceso adiabático para un gas perfecto, la transferencia de calor hacia el sistema o proveniente de él es cero. El cambio de presión con respecto al volumen obedece la ley
Es cuando un sistema no gana ni pierde calor, es decir, Q = 0. Este proceso puede realizarse rodeando el sistema de material aislante o efectuándolo muy rápidamente, para que no haya intercambio de calor con el exterior.
Es cuando un sistema no gana ni pierde calor, es decir, Q = 0. Este proceso puede realizarse rodeando el sistema de material aislante o efectuándolo muy rápidamente, para que no haya intercambio de calor con el exterior.
En consecuencia,

Proceso adiabático, en termodinámica, cualquier proceso físico en el que magnitudes como la presión o el volumen se modifican sin una transferencia significativa de energía calorífica hacia el entorno o desde éste.

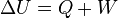
 es la variación de energía del sistema,
es la variación de energía del sistema, 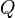 es el calor intercambiado por el sistema a través de unas paredes bien definidas, y
es el calor intercambiado por el sistema a través de unas paredes bien definidas, y  es el trabajo intercambiado por el sistema a sus alrededores.
es el trabajo intercambiado por el sistema a sus alrededores. 

